P5
Die Rolle Alarmins S100A8/A9 und seines Rezeptors TLR4/MD2 auf Thrombozyten in der Regulation der Inflammation, der Glykokalyx Integrität und der vaskulären Permeabilität während der Inflammation
Zusammenfassung
Neben Neutrophilen Granulozyten sind auch Thrombozyten aktiv an der Pathogenese von Entzündungsprozessen beteiligt und können sich an aktivierte Endothelzellen anheften. Das pro-inflammatorische Alarmin S100A8/A9 (Calprotectin, Mrp8/14) wird in Zellen myeloischen Ursprungs, z.B. Neutrophilen und Monozyten, stark exprimiert. Das S100A8/A9-Heterodimer wurde als entscheidender Akteur bei vielen entzündlichen Erkrankungen identifiziert und gehört zur S100-Familie der Ca2+-bindenden Proteine. Die Wechselwirkung von Neutrophilen mit Blutplättchen ist wesentlich für die Bildung von NETs, die ein wesentlicher Bestandteil vieler Entzündungsereignisse sind. NETs entfernen zirkulierende Bakterien aus dem Blutkreislauf und können eine erhöhte Gefäßpermeabilität induzieren. Die endotheliale Glykokalyx ist eine dynamische Struktur, die auf der luminalen Seite des Endothels lokalisiert ist und eine zentrale Rolle im Zusammenhang mit der Gefäßpermeabilität spielt.
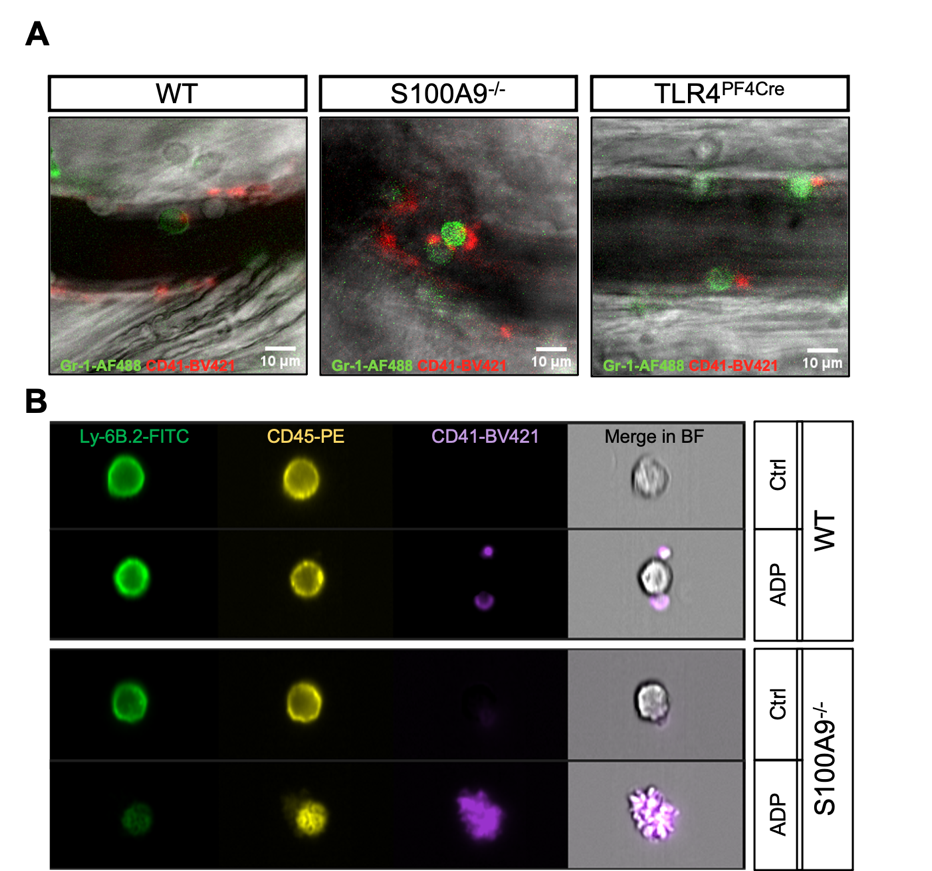
Figure: A) Platelet-neutrophil complexes in postcapillary venules of the murine cremaster muscle and B) neutrophil-platelet complexes in the circulation.
Hauptbestandteile der Glykokalyx sind membrangebundene Proteoglykane und Glykoproteine, die aus Plasma und Endothel stammende lösliche Komponenten enthalten und Teil der Endothelbarriere sind. Gefäßentzündungen führen zum Abbau der endothelialen Glykokalyx. Gefäßentzündungen induzieren auch die Spaltungsaktivität der Enzyme Heparanase und Hyaluronidase, was zur Ausscheidung der Glycocalyx-Komponenten Syndecan-1 und Hyaluronsäure führt. Heparanase und Hyaluronidase werden ebenfalls von aktivierten Blutplättchen exprimiert und freigesetzt und tragen weiter zum Abbau der endothelialen Glykokalyx und der subendothelialen extrazellulären Matrix bei. Wie von Neutrophilen stammendes S100A8/A9 die NET-Bildung beeinflusst und anschließend die Aktivierung und Beteiligung von Blutplättchen an der Leukozytenrekrutierung, dem Abbau der Glykokalyx und der Expansion und/oder Aktivierung von „Myeloid-derived suppressor cells“ (MDSCs) moduliert, ist unbekannt.




