P1
Zielgerichtete Nozizeptoren zur Modulation der Neutrophilen-Mobilisierung und -Homing bei Sepsis
Zusammenfassung
Sepsis ist eine lebensbedrohliche Immunreaktion, die durch das Eindringen von (zumeist bakteriellen) Krankheitserregern in den Blutkreislauf ausgelöst wird. Patienten mit einer Sepsis weisen Hypotonie, Gewebeödeme und eine beeinträchtigte Mikrozirkulation auf, was wiederum zu Gewebehypoxie, Organfunktionsstörungen und einer hohen Letalität führt. Auf zellulärer Ebene induziert eine Sepsis eine endotheliale Funktionsstörung und nachfolgendem Integritätsverlust der Endothelbarriere. Obwohl präklinische Untersuchungen darauf hinweisen, dass der Erhalt der Endothelfunktion während der Sepsis die Komplikationsrate reduzieren kann, sind die zugrundeliegenden Mechanismen bis dato noch nicht vollständig verstanden. Zur Limitierung der endothelialen Funktionsstörung und Verbesserung der Mikrozirkulation während einer Sepsis steht bisher kein therapeutisches Instrument zur Verfügung.
Procalcitonin ist ein Hormokin aus 116 Aminosäuren, welches während der Sepsis von Immun- und Parenchymzellen ubiquitär exprimiert wird. Die Plasma-konzentration von Procalcitonin steigt während der Sepsis bis zu 100.000-fach an und korreliert mit dem Schweregrad und den Folgen der Sepsis. Procalcitonin ist ein klinisch gut charakterisierter Biomarker für die Diagnose, Behandlung und Prognose von septischen Patienten. Es ist jedoch noch nicht bekannt, welche pathophysiologische Rolle Procalcitonin während einer Sepsis spielt. Unsere bisherigen Studien und vorläufigen Daten zeigen, dass Procalcitonin selbst ein Mediator der endothelialen Funktionsstörung ist. Procalcitonin induziert eine Schädigung der Endothelbarriere, indem es die Verfügbarkeit von VE-Cadherin auf dem Endothel verringert und so in vivo zu einem Gewebeödem führt. Originäres Procalcitonin (PCT1-116) wird durch Dipeptidylpeptidase IV (DPPIV) zu PCT3-116 gespalten. Unsere vorläufigen Daten zeigen, dass die Spaltung von PCT1-116 durch DPPIV die Zerstörung der Barrierefunktion auslöst.
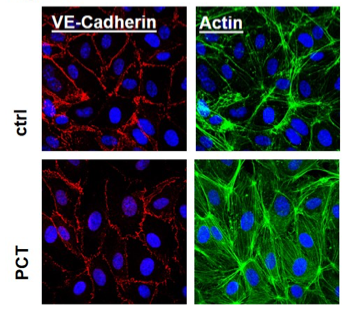
Procalcitonin (PCT) erhöht die endotheliale Permeabilität und induziert die Phosphorylierung und Internalisierung von VE-Cadherin. Immunohistochemie von 1ng/ml PCT oder vehikel-behandelten Endothelzellen der Nabelschnurvene (HUVECs: Human Umbilical Vein Endothelial Cells) zeigt, dass PCT die Verteilung von VE-Cadherin und die Bildung von Actinstressfilamenten induziert.
Unsere Hypothese ist, dass PCT3-116 ein durch DPPIV generierter Auslöser der endothelialen Funktionsstörung während einer Sepsis ist. Daher könnte DPPIV während einer systemischen Entzündung als therapeutisches Ziel zur Erhaltung der Gefäßintegrität dienen, indem die Verfügbarkeit von aktivem Procalcitonin limitiert wird. Diese Hypothese werden wir durch die Identifizierung des mutmaßlichen Procalcitoninrezeptors auf Endothelzellen, sowie durch die Charakterisierung der Procalcitonin-induzierten Signalwege und durch die Analyse der Funktion von VE-Cadherin als nachgelagertes Ziel von Procalcitonin prüfen.
Außerdem werden wir die Auswirkungen von DPPIV-Inhibitoren auf die Procalcitoninspiegel und die Hämodynamik bei septischen Schweinen untersuchen. In einer Pilotstudie mit Patienten, die sich einem kardiochirurgischen Eingriff unterziehen, werden wir den potentiellen Einsatz von DPPIV-Inhibitoren zur Senkung des Procalcitoninspiegel, der Begrenzung der Mikrozirkulationsstörung und den Einfluß auf die Inzidenz eines systemischen inflammatorischen Response-Syndrom untersuchen.
Unser Ziel ist die Charakterisierung der Rolle von Procalcitonin als potenten Induktor der Endothelbarriere-Funktionsstörung und klinisch zugelassene DPPIV-Inhibitoren als potentielle therapeutische Option zur Erhaltung der Endothelintegrität, des Mikrozirkulationsflusses und der Organperfusion bei einer systemischen Inflammation mit einer Hyperprocalcitonämie zu etablieren.




