P3
Myeloide Differenzierung bei systemischer Inflammation
Zusammenfassung
Systemische Inflammationerkrankungen sind weltweit eine der Hauptfaktoren für Morbidität und Letalität. Die Pathophysiologie der systemischen Inflammation und die Ursachen des Multiorganversagens sind jedoch noch wenig bekannt. Die systemische Entzündungsreaktion besteht typischerweise aus zwei Phasen: einer akuten hyper-inflammatorischen Reaktion, die gekennzeichnet ist durch eine überschießende Entzündung sowie eine starke Aktivierung der angeborenen Immunmechanismen und einer anschließenden anti- oder hypo-inflammatorischen Phase, die entweder zur Auflösung der Entzündung und der Gewebereparatur führt oder in eine anhaltende Phase der inadäquaten Entzündungsreaktion übergeht, die einen Hauptrisikofaktor für die Mortalität der systemischen Inflammation darstellt.
Monozyten und Makrophagen spielen je nach Differenzierungs- und Aktivierungsstadium eine wichtige Rolle bei der pro- oder anti-inflammatorischen Regulation systemischer Entzündungsreaktionen. Ziel dieses Projekts ist es, die Rolle von zwei Zielmolekülen zu charakterisieren, die in pro-inflammatorische (S100A8 / S100A9) und anti-inflammatorische (CD163) Monozyten- / Makrophagenfunktionen während systemischer Entzündungen involviert sind. Die Expression dieser Moleküle und der Differenzierungsgrad von Monozyten werden antagonistisch durch den Myeloid-Transkriptionsfaktor Interferon-Regulationsfaktor 8 (IRF8) reguliert.
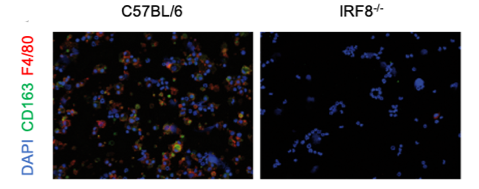
Die Abhängigkeit von CD163⁺ Makrophagen vom Interferon-Regulationsfaktor 8 (IRF8). Immunofluoreszenzanalyse der CD163 Expression im Knochenmark von Mäusen (wt: wildtype und IRF8-/-).




