P7
Multidimensionale Profilerstellung von neuen Mediatoren und therapeutischen Zielen betreffend die AKI während einer systemischen Inflammation
Zusammenfassung
Die akute Nierenschädigung (acute kidney injury – AKI) ist eine häufige Komplikation bei kritisch kranken Patients mit Sepsis. Die AKI hat einen erheblichen Einfluss auf die kurz- und langfristigen Krankheitsverläufe der Patienten und geht mit einer deutlich höheren Sterblichkeit einher. Da es keine suffiziente therapeutische Option gibt (bis auf die Durchführung einer Nierenersatztherapie bei Patienten mit schwere AKI als rein supportive Maßnahme), ist der Prävention eine große Bedeutung zuzuschreiben. Die entfernte, ischämische Präkonditionierung (remote ischemic preconditioning – RIPC) besteht aus definierten Episoden einer Ischämie und Reperfusion, bevor die letztendliche Schädigung des Zielorgans auftritt. Wir konnten bereits zeigen, dass die Anwendung von RIPC (3 Zyklen von jeweils 5 Minuten) vor einer Herzoperation das Auftreten einer AKI bei Hochrisikopatienten signifikant reduziert (37,5% gegenüber 52,5% in der Kontrollgruppe; p = 0,02). Darüber hinaus konnten wir beobachten, dass ein früher und transienter Anstieg (vor der Operation) der beiden G1-Zellzyklusarrestmarker TIMP2 und IGFBP7 mit einer verminderten Inzidenz der AKI verbunden war. Weiter zeigten Patienten bereits frühzeitig nach Anwendung der RIPC signifikant erhöhte HMGB1-Konzentrationen (High Mobility Group Box 1) im Urin im Vergleich zur Kontrollgruppe. HMGB1 ist ein Alarmin aus der Gruppe der DAMP-Moleküle (Damage Associated Molecular Pattern), welches als Reaktion auf Zellstress freigesetzt wird. Diese Moleküle fungieren als Signalvermittler zum Auslösen endogener Reaktionen, z.B. der Aktivierung des angeborenen Immunsystems.
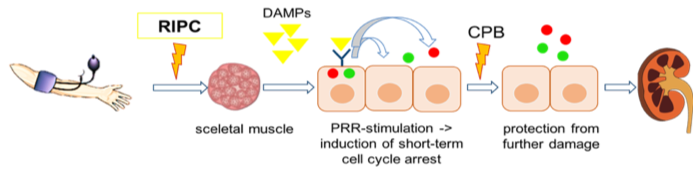
Konzeptmodell der RIPC (remote ischemic preconditioning): Die Anwendung der RIPC setzt DAMPs aus den Skelettmuskelzellen frei. Diese DAMPs werden im Glomerulus filtriert und binden anschließend an Mustererkennungsrezeptoren (pattern recognition receptors – PRRs) der tubulären Nierenepithelzellen. Dadurch wird ein kurzfristiger Zellzyklusarrest induziert, der die Zellen vor weiterer Schädigung schützt (z.B. ischämische Reperfusionsschäden bei kardiopulmonalem Bypass).
In einer experimentellen Vorläuferstudie konnte bereits gezeigt werden, dass eine HMGB1 Applikation vor einem Schädigungsereignis eine AKI abschwächen kann. Es zeigte sich zudem, dass diese Wirkung durch die Aktivierung von AMPKα und NF-κB zu einer Hochregulation von Sema5b führte, welches wiederum einen transienten, protektiven Zellzyklusarrest induziert.
Ziel des aktuellen Projektes ist es nun, die Ergebnisse, die wir aus der herzchirurgischen Kohorte gewonnen haben, nun auf kritisch kranke Patienten mit früher Sepsis zu übertragen. Zudem möchten wir weitere Erkenntnisse zum pathophysiologsichen Hintergrund durch die Verwendung renale Organoidmodelle gewinnen. Es werden folgenden drei Ziele verfolgt: Ziel 1: Validierung und mechanische Analyse neuer potentieller Mediatoren und therapeutischer Ziele in AKI und RIPC. Ziel 2: Molekulare Charakterisierung der Rolle von Bst2 in der Pathogenese von AKI. Ziel 3: Untersuchung der Rolle von RIPC auf SA-AKI.




