Pilotprojekt
PP1
Die Wirkung der Hypoalbuminämie auf endotheliale S1P Signalwege bei Sepsis
Zusammenfassung
Hypoalbuminämie, definiert als Serumalbuminwert unter 3,5 g/dl, wird häufig bei schwerkranken Patienten beobachtet. Der Schweregrad der Hypoalbuminämie korreliert umgekehrt mit einer Hypermeabilität der Kapillaren, der sogenanntes Kapillarleckage. Die konsekutive Bildung von Ödemen in lebenswichtigen Organen (Lunge, Niere, Herz) in Kombination mit intravaskulärer Hypovolämie spielt eine entscheidende Rolle in der Pathophysiologie des septischen Schocks und der Multiorganfunktionsstörung.
Die Kapillarpermeabilität wird durch eine kohlenhydratreiche Schutzschicht auf dem Gefäßendothel, der endothelialen Glykokalyx (eGC), reguliert. Das eGC ist bis zu 3 μm dick, besteht größtenteils aus hochsulfatierten Glykosaminoglykanen und Proteoglykanen und spielt eine entscheidende Rolle bei der Aufrechterhaltung der Mikrozirkulationshomöostase. Insbesondere wirkt der eGC als negativ geladene „Firewall“, um die Wechselwirkungen zwischen Leukozyten und Endothel zu reduzieren. Seine kohlenhydratreiche Matrix bietet Widerstand gegen Wasserdurchlässigkeit (hydraulische Leitfähigkeit) und trägt zum Anteil der Albuminmoleküle bei, die von der Gefäßwand zurück ins Plasma „reflektiert“ werden (Reflexionskoeffizient). Interessanterweise scheint die Zerstörung Glykokalyx ein wesentlicher, vielleicht sogar der erste Auslöser für die Entwicklung von Hyperpermeabilität und Ödemen bei schwerkranken und insbesondere bei septischen Patienten zu sein.
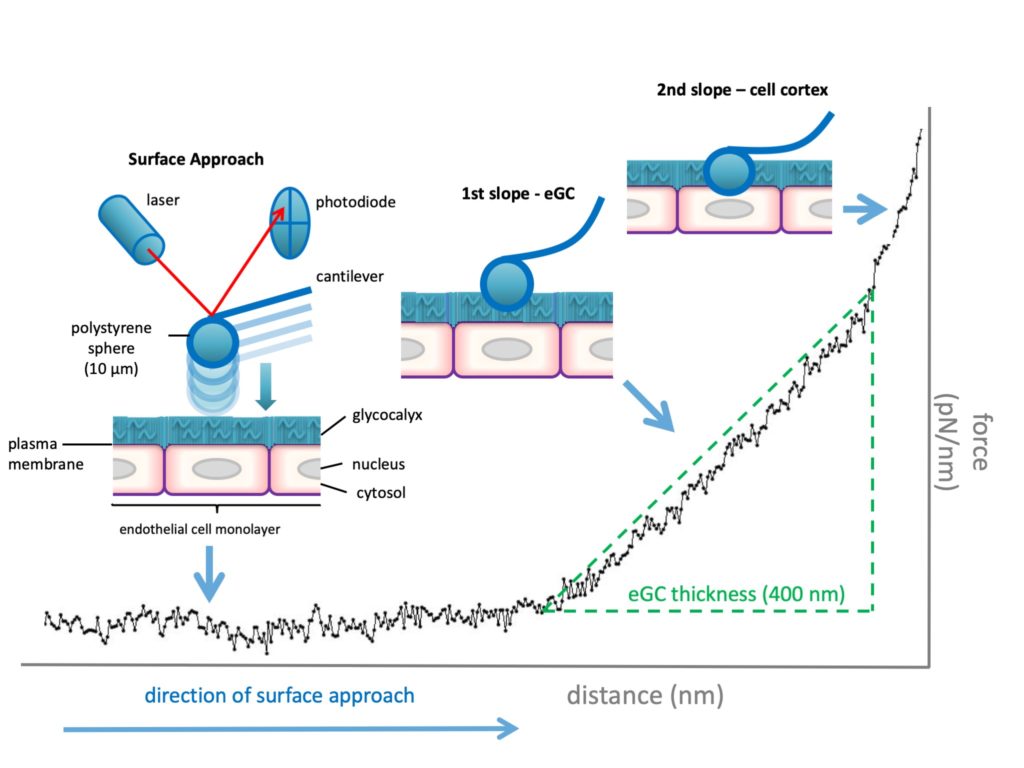
Analyse der endothelialen Glykokalyx mittels Rasterkraftmikroskopie (atomic force microscopy, AFM).
Zwischenüberschrift
Unsere vorläufigen Daten zeigen, dass Hypoalbuminämie bei Sepsis zu einer direkten Schädigung der endothelialen Glykokalyx (eGC) führt. Unser vorgeschlagenes Forschungsprojekt untersucht die Hypothese, dass dieser Glykokalyxschaden durch den Verlust des endothelialen Sphingosin-1-phosphat (S1P)-Signals verursacht wird und sieht vor die damit verbundenen molekularen Mechanismen aufzudecken.
Insbesondere möchten wir die mögliche Schutzwirkung von Albumin-gebundenem S1P sowie das Ausmaß untersuchen, in dem die durch Sepsis induzierte Hyperpermeabilität der Gefäßbarriere spezifisch mit eGC-Schäden zusammenhängt. Das Ziel unseres translationalen Projekts ist die Untersuchung neuer molekularer Ansätze und personalisierter Strategien in der Sepsis-Therapie zu erforschen.
Projektteam

PD Dr. med.
Jan Rossaint

PD Dr. med.
Jan Rossaint

PD Dr. med.
Jan Rossaint

